
Mary E. Brunkow, Fred Ramsdell e Shimon Sakaguchi sono i vincitori del Premio Nobel per la Medicina 2025 grazie alle loro scoperte sulla tolleranza immunitaria periferica, il meccanismo che impedisce al sistema immunitario di danneggiare il nostro stesso organismo combattendo solamente i patogeni esterni. Le scoperte dei tre scienziati si riferiscono a studi del 1995, del 2001 e del 2003 in cui hanno definito il ruolo di un particolare tipo di cellule immunitarie, i linfociti T regolatori o Treg. Questa scoperta si è rivelata importante nello sviluppo di terapie per combattere malattie immunitarie, rigetto degli organi per i trapianti e tumori.
Come fa il sistema immunitario a non attaccare il nostro stesso corpo: la tolleranza immunitaria periferica
Il sistema immunitario ha il compito di riconoscere ed eliminare agenti patogeni esterni come virus e batteri. Per farlo produce un vasto repertorio di cellule specializzate a riconoscere specifiche molecole, gli antigeni. Queste si dividono in due "squadre" principali: le cellule dell'immunità innata, come i fagociti, che forniscono la prima e immediata linea di difesa, e quelle dell'immunità adattativa, come i linfociti B (che producono gli anticorpi) e i linfociti T, che sviluppano una risposta mirata e duratura.
I linfociti T, nello specifico, hanno dei "sensori" sulla loro superficie, i recettori delle cellule T, che grazie alla loro particolare forma riescono a riconoscere ciò che è estraneo e pericoloso da ciò che è innocuo. Una volta captata una molecola sospetta, si innesca una serie di segnali che attivano altre cellule che entrano in azione uccidendo il patogeno.
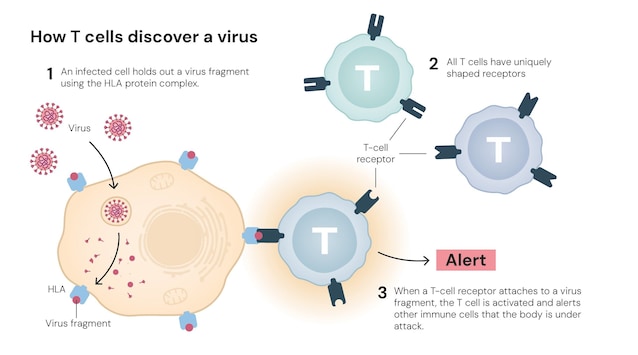
Esistono diversi tipi di linfociti T, ognuno con un ruolo specializzato nel sistema immunitario, per esempio: le cellule T Helper, che coordinano la risposta immunitaria e le cellule T Citotossiche, che agiscono come "killer" eliminando direttamente le cellule infette o tumorali.
Non sempre però queste cellule sono in grado di riconoscere solamente i "nemici" del nostro organismo, esistono infatti le malattie autoimmuni che si verificano quando le cellule immunitarie attaccano le nostre stesse cellule riconoscendo i cosiddetti antigeni self. È il caso di patologie come l'artrite reumatoide, la sclerosi multipla e il diabete di tipo 1.
Il complesso meccanismo che controlla il nostro corpo possiede dei metodi per prevenire queste situazioni indesiderate: la tolleranza immunitaria. Si tratta di una proprietà fondamentale del sistema immunitario che si sviluppa su due livelli, la tolleranza centrale e la tolleranza periferica – premiata con il Nobel.
- Tolleranza centrale: è stata la "teoria dominante" negli anni '80, secondo cui i linfociti T venissero "educati" nel timo, una ghiandola collocata nel torace, a non attaccare le cellule del proprio corpo. Tuttavia, era già noto che questo processo non fosse perfetto e che alcuni linfociti T auto-reattivi riuscissero a "sfuggire" a questo controllo.
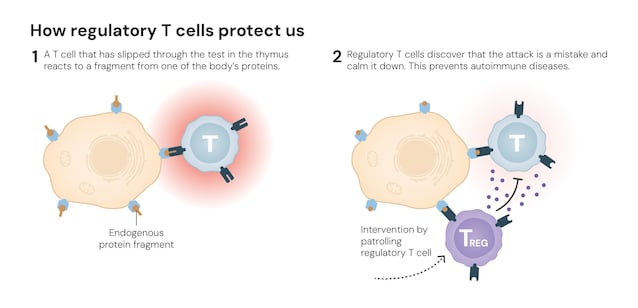
- Tolleranza periferica: il controllo sulle cellule "difettose" non si esaurisce nel timo. C'è un secondo livello di sicurezza attuato da una terza classe di cellule T, i linfociti T regolatori o Treg che hanno il compito di "sopprimere" le risposte immunitarie eccessive, prevenendo le reazioni autoimmuni.
Proprio le scoperte che hanno permesso di comprendere quest'ultimo processo sono state premiate con il Premio Nobel per la Medicina a Mary E. Brunkow, Fred Ramsdell e Shimon Sakaguchi.
Chi sono i tre vincitori del Premio Nobel per la Medicina e cos'hanno scoperto
Shimon Sakaguchi (1951), oggi Professore Emerito all'Università di Osaka, nel 1995 quando si pensava che la tolleranza si sviluppasse solo nel timo, identificò attraverso esperimenti sui topi, una popolazione di linfociti T (caratterizzati dalle proteine CD4 e CD25 sulla superficie) in grado di agire come "guardiani", tenendo a freno il sistema immunitario e proteggendo il corpo dalle malattie autoimmuni.
Nonostante la scoperta, molti ricercatori rimasero scettici. Le prove definitive che avrebbero confermato la sua teoria sarebbero arrivate dal lavoro di altri due scienziati, Mary Brunkow – nata nel 1961 e Senior Program Manager all'Institute for Systems Biology di Seattle – e Fred Ramsdell – classe 1960 attualmente consulente scientifico per Sonoma Biotherapeutics – che stavano studiando un ceppo di topi malati, i topi "scurfy" in un laboratorio statunitense. I due ricercatori hanno individuato una mutazione nel gene Foxp3 sul cromosoma X responsabile della malattia. Questo gene era difettoso anche nei bambini affetti da sindrome IPEX, una malattia autoimmune.
L'unione delle scoperte ha permesso di dimostrare che il gene Foxp3 è proprio l'interruttore che programma lo sviluppo e la funzione delle cellule T regolatorie, svelando così il meccanismo molecolare alla base della capacità del corpo di tollerare se stesso.
Come affermato da Olle Kämpe, presidente del Comitato per il Nobel:
Le loro scoperte sono state decisive per comprendere il funzionamento del sistema immunitario e il motivo per cui non tutti sviluppiamo gravi malattie autoimmuni.
Applicazioni e sviluppi della scoperta valsa il Premio Nobel
Il Premio Nobel per la Medicina 2025 è stato assegnato per scoperte avvenute più di 20 anni fa. Come mai è passato tanto tempo? La risposta, come per ogni Premio Nobel, sta nelle applicazioni pratiche: solo negli ultimi anni, la migliore comprensione del ruolo delle cellule T regolatorie ha permesso di pensare e sviluppare nuove strategie terapeutiche nella medicina. Si sono aperte infatti prospettive di cura concrete in aree come le malattie autoimmuni, i trapianti d'organo e l'oncologia.
Potenziare l'azione delle cellule Treg potrebbe essere cruciale per combattere le malattie autoimmuni e per ridurre il rischio di rigetto nei trapianti. In oncologia, invece, la strategia da utilizzare è opposta, bloccare la funzione delle Treg che vengono usate dalle cellule tumorali come difesa dalle altre cellule immunitarie.
;Resize,width=767;)

;Resize,width=767;)
;Resize,width=727;)
;Resize,width=727;)
;Resize,width=727;)



