
Sarebbe possibile sostituire i nostri organi mano a mano che si danneggiano o che invecchiano, quasi come se fossimo macchine in un'officina? Cuore nuovo, fegato nuovo, polmoni nuovi… e così via. L’idea, a cui il presidente russo Putin qualche tempo fa si è detto molto interessato, suona affascinante, ma anche un po’ inquietante: se bastasse cambiare i pezzi, perché non dovremmo vivere per sempre? Eppure, la scienza è chiara: il nostro organismo non funziona come un motore in cui basta sostituire un pezzo rotto. Dietro la promessa dell’“immortalità tecnica” si nascondono muri invalicabili: la biologia del nostro corpo, il declino del sistema immunitario, i limiti posti dall’evoluzione, il rischio di tumori e la fragilità del cervello ci ricordano che un corpo umano non è un’auto da riparare. Per questi motivi, l’immortalità biologica rimane fuori dalla nostra portata. I trapianti, i farmaci, persino gli esperimenti più audaci non cancellano i limiti impressi nella nostra biologia. Questo non vuol dire arrendersi: oggi viviamo più a lungo e meglio di qualsiasi generazione passata. La sfida vera non è diventare eterni, ma allungare gli anni di salute, ridurre le malattie croniche e rendere la vecchiaia un tempo dignitoso e ricco.
Perché non esistono organismi immortali? Le teorie che spiegano perché invecchiamo
Il concetto di immortalità ha da sempre affascinato l'umanità, ma la biologia ci insegna che l'invecchiamento è una parte quasi inevitabile della vita. Questo solleva una domanda fondamentale: perché la natura non ha mai selezionato organismi immortali?
La risposta potrebbe arrivare da due teorie che hanno fatto scuola. Negli anni ’50 George C. Williams sviluppò la teoria della pleiotropia antagonistica: geni che in gioventù portano vantaggi, come più fertilità o forza, possono diventare un fardello in età avanzata, contribuendo all’invecchiamento. È il paradosso di un gene che “vince” presto, ma “perde” sul lungo termine.
Vent’anni più tardi, Tom Kirkwood propose la teoria del corpo (soma) usa e getta: l’energia di un organismo è limitata, e la natura l’ha investita soprattutto nella riproduzione, non nella manutenzione infinita del corpo. In altre parole, per l’evoluzione contava che i geni passassero alla generazione successiva, non che il singolo individuo vivesse in eterno.
Perché il corpo umano invecchia? I 12 tratti dell’invecchiamento
Il nostro organismo ha sistemi di controllo e rigenerazione in grado di far fronte a mutazioni, danni cellulari piccoli e grandi, ma questi non funzionano all'infinito. Nel 2023 un gruppo di scienziati ha aggiornato i tratti distintivi dell'invecchiamento, anche conosciuti come “hallmarks of aging”, cioè quel quadro teorico che gli scienziati usano per descrivere i meccanismi fondamentali che causano l’invecchiamento. A oggi, sono identificati dodici processi che insieme consumano il corpo. Ecco quali sono:
- Instabilità genomica: il DNA accumula errori e danni, rendendo le cellule meno affidabili.
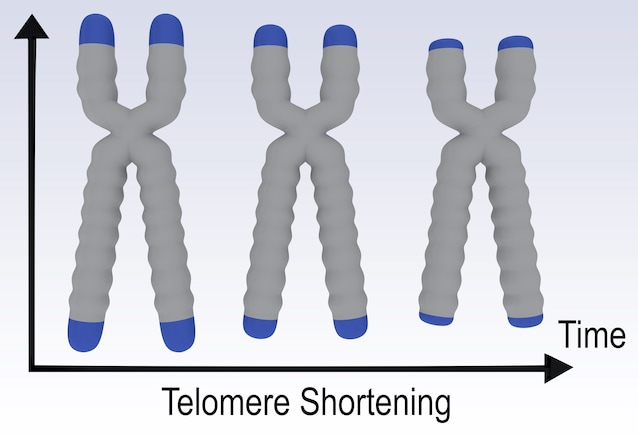
- Accorciamento dei telomeri: le estremità dei nostri cromosomi, i telomeri agiscono come dei "cappucci" che proteggono il nostro materiale genetico, ma si accorciano a ogni divisione cellulare, finché la cellula non può più replicarsi.
- Alterazioni epigenetiche: i “comandi” che accendono e spengono l'espressione dei geni si alterano, così le cellule perdono parte della loro identità.
- Perdita di proteostasi: le proteine si piegano male o si accumulano senza essere smaltite, disturbando, in questo modo, le funzioni cellulari.
- Disfunzione mitocondriale: le centrali energetiche delle nostre cellule, i mitocondri, producono meno energia e più scorie dannose.
- Senescenza cellulare: le cellule danneggiate smettono di dividersi o andare in apoptosi (morte programmata), ma restano attive, rilasciando segnali infiammatori nocivi e cronici.
- Esaurimento delle cellule staminali: le cellule staminali, cioè cellule immature in grado di specializzarti in qualsiasi altro tipo cellulare, un po' come se fossero i “pezzi di ricambio” del corpo, si riducono, e quindi i tessuti si riparano più lentamente.
- Alterata comunicazione intercellulare: le cellule non si scambiano più messaggi chiari e i segnali diventano confusi.
- Disregolazione del sensing dei nutrienti: i sensori interni che regolano metabolismo e crescita funzionano male, favorendo disturbi come diabete e obesità.
- Infiammazione cronica (inflamm-aging): un allarme infiammatorio debole ma continuo logora organi e tessuti.
- Declino del sistema immunitario (immunosenescenza): diminuisce la produzione di nuove difese immunitarie e sono anche meno efficaci, quindi il corpo risponde peggio a virus e infezioni.
- Alterazioni del microbiota e delle barriere tissutali: l’equilibrio della flora intestinale e della pelle si rompe, rendendo il corpo più vulnerabile a patogeni esterni.
Vediamo alcuni di questi processi nel dettaglio.
Accumuliamo mutazioni genetiche
Durante la vita, il nostro DNA accumula una serie di mutazioni, spontanee o derivate da fattori ambientali che possono alterare le informazioni contenute nel nostro materiale genetico. Uno studio, pubblicato su Nature nel 2022, ha analizzato 208 criptiche intestinali, piccole ghiandole a forma di tubo situate nella mucosa intestinale, di 16 specie diverse: risultato sorprendente, l’uomo accumula circa 47 mutazioni per cellula ogni anno, il topo quasi 800. Eppure, a fine vita, entrambi arrivano a un totale simile: circa 3000 mutazioni per cellula. Più mutazioni, vuol dire una maggiore probabilità di avere mutazioni sfavorevoli che potrebbero portare a sviluppare patologie: per esempio, vuol dire un'ampia probabilità di sviluppare un tumore o un cancro.
Difese immunitarie più fragili e infiammazione in crescita
Con l’età, il nostro esercito interno si sfilaccia. Il timo – la “scuola di addestramento” dei linfociti T – comincia a ridursi già dopo la pubertà e, nella vecchiaia, la sua attività è quasi spenta. Risultato: poche reclute nuove e difese sempre più deboli.
In parallelo, il corpo produce continuamente molecole infiammatorie come l’IL-6. È il fenomeno dell’inflamm-aging: un’infiammazione cronica, silenziosa ma logorante, che prepara il terreno a malattie cardiovascolari, tumori e Alzheimer.
Il cervello è un organo che non si cambia
Grazie a un metodo ingegnoso basato sul carbonio-14, il gruppo di Jonas Frisén al Karolinska Institute ha dimostrato che l’ippocampo umano produce circa 700 nuovi neuroni all’anno. Una cifra minima: se l’ippocampo riesce a rigenerarsi un po’, la corteccia cerebrale invece non lo fa quasi per nulla. Per questo si può dire che i neuroni che avevi a vent’anni sono, in gran parte, gli stessi che ti accompagnano fino agli ottanta. Ed è qui che emerge il limite più profondo: non possiamo “sostituire” il cervello come facciamo con altri organi, perché le cellule che custodiscono la memoria, i ricordi e la coscienza restano con noi per tutta la vita. Invecchia il corpo, ma invecchia anche la nostra identità, nel senso che si logorano le strutture biologiche che la sostengono. Non solo. Esperimenti di laboratorio di Toyama pubblicati su Cell nel 2013, hanno mostrato che alcune proteine del cervello restano intatte per decenni. Non vengono riciclate, ma accumulano danni ossidativi che le irrigidiscono, come ingranaggi arrugginiti che nessuno sostituisce.
La senescenza cellulare: un meccanismo di protezione a doppio taglio
Più una cellula si divide, più rischia di sbagliare. Lo ha dimostrato uno studio del 2017 su diversi tessuti: i tumori sono molto più frequenti negli organi a rapido ricambio, come il colon o i polmoni, rispetto al cervello. Per difendersi, il corpo usa la senescenza cellulare: una sorta di freno d’emergenza che blocca la proliferazione delle cellule. Funziona come barriera contro il cancro, ma c’è un prezzo da pagare. Le cellule senescenti, anche se non si dividono più, restano attive e rilasciano sostanze tossiche che danneggiano i tessuti circostanti.
I trapianti sono una vittoria parziale
I trapianti sono una conquista straordinaria, ma hanno limiti precisi. Secondo il registro internazionale dell’International Society for Heart and Lung Transplantation (ISHLT, Associazione Internazionale per i Trapianti di Cuore e Polmoni), che raccoglie oltre 108.000 trapianti di cuore dal 1992 al 2018, la sopravvivenza a un anno oggi si aggira intorno all’85–90%. A cinque anni, la sopravvivenza condizionale resta elevata, con valori superiori all’85% in Europa e Nord America. Una complicanza cronica – la vasculopatia d’innesto – rimane comunque la principale causa di fallimento a lungo termine.
E anche se la scienza sperimenta nuove strade, come gli xenotrapianti da maiali geneticamente modificati, i risultati sono ancora agli inizi. In uno studio del 2022, due reni di maiale sono stati trapiantati in pazienti in morte cerebrale e hanno funzionato per 54 ore, producendo urina e mantenendo una buona filtrazione senza segni di rigetto immediato. Un successo tecnico, certo, ma ancora lontanissimo dall’idea di un ricambio “a vita”.
Esiste un limite di età massimo?
Un’analisi pubblicata su Nature nel 2016 suggerisce che la durata massima della vita umana si aggiri intorno ai 115 anni. Altri scienziati, studiando 3836 italiani ultracentenari, hanno notato che dopo i 105 anni il rischio di morte si stabilizza intorno al 50% all’anno. In altre parole: a quell’età, ogni anno è come lanciare una moneta. Non c’è un muro invalicabile, ma le probabilità giocano contro.
;Resize,width=767;)
;Resize,width=578;)
;Resize,width=767;)



;Resize,width=727;)
;Resize,width=727;)

